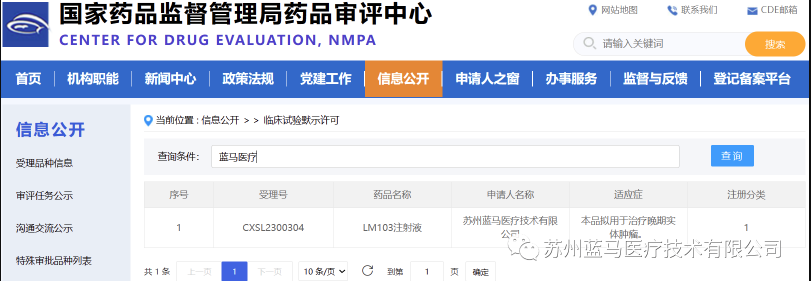
2023年7月13日,國家藥監局藥品審評中心(CDE)官網顯示,Medpark園內企業蘇州藍馬醫療技術有限公司(以下簡稱:藍馬醫療)LM103注射液(TILs)正式獲得國家藥品監督管理局(NMPA)的臨床試驗默示許可。
國內TILs領域首個使用滋養細胞(以下簡稱:Feeder)工藝的臨床許可
根據公開信息,TILs全球龍頭Iovance Biotherapeutics(以下簡稱:Iovance),目前公布的所有臨床數據都是基于使用滋養細胞(以下簡稱:Feeder)生產工藝制備的TILs,Feeder是保證TILs細胞質量和數量的關鍵工藝原材料。藍馬醫療利用自己的T-Feeder平臺對Feeder的制備及其在TILs培養中的使用工藝進行了優化,有效縮短TILs培養制備時間,提高制備效率,同時通過嚴格的質控策略確保使用產品安全性,并通過研究者發起臨床研究初步證明了采用Feeder工藝的TILs在臨床上的安全性和有效性。
藍馬醫療遵循了包括Iovance在內的主流商業公司及癌癥中心對于Feeder不可或缺性的共識,成為國內第一家在工藝中使用Feeder生產工藝并獲得臨床許可的TILs企業,依靠其獨特的工藝,確保TILs成品在細胞數量、細胞質量、制備成功率等多個關鍵指標上的優異表現,目前公司與Feeder相關專利已獲得受理。
關于LM103注射液
藍馬醫療產品LM103注射液(TILs)通過藍馬醫療自有工藝開發,在滿足最高可達細胞數量(>1X1011)、細胞活度(>90%)、最快擴增速度(22天工藝)及高擴增倍數(數千倍)等關鍵技術指標基礎上,保證了穩定的制備成功率。得益于此,公司所開發LM103注射液對初始腫瘤體積小或穿刺來源組織的患者的TILs制備具備獨特的技術優勢,能為更多實體腫瘤患者提供治療選擇和服務。
TILs最新國際臨床進展
2023年7月10日,Iovance Biotherapeutics宣布TILs療法監管方面最新進展,在一次Type B三期臨床前會議上,收到FDA反饋認可IOV-LUN-202的臨床設計,作為加速批準的必要條件意味著LN-145作為PD-1抗體的后線治療可能獲得加速批準。這意味著IOVANCE兩款核心TILs療法產品上市都具備了很大確定性,如果Iovance Lifileucel獲批,將成為首款獲批上市的實體腫瘤細胞治療產品,具有里程碑意義。
關于藍馬醫療
蘇州藍馬醫療技術有限公司(以下簡稱:“藍馬醫療”)成立于2020年12月,是一家位于蘇州高新區,專注于開發以腫瘤浸潤性淋巴細胞(TILs)療法產品為核心的生物醫藥企業,細胞免疫治療在國外惡性腫瘤治療中已取得了顯著的臨床療效,目前公司主要在研產品覆蓋包括宮頸癌、非小細胞肺癌、惡性黑色素瘤、頭頸腫瘤等在內的實體瘤種。
藍馬醫療創始人團隊在TILs療法研發和產業化方向深耕多年,其中包括來自MD安德森癌癥研究中心TIL試驗室等機構及進度領先的商業化公司的資深科學家。從科研界到產業界,創始人團隊在TILs療法領域已經積累了近20年產品生產、質控及團隊管理經驗。
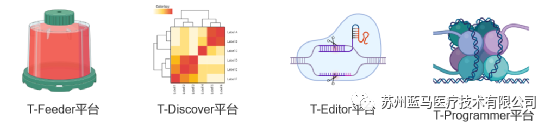
自成立以來,藍馬醫療已經搭建了四大技術平臺,包括T-Feeder平臺(基于滋養細胞的TILs生產工藝研發平臺,保障了TILs能快速擴增至1010~11級別,且活率、表型、功能表現優異)、T-Discover平臺(立足于臨床樣本的新靶點發現平臺,有助于深入探究TILs療法的MOA,為優化TILs的性質和功能提供了新靶點)、T-Editor平臺(基因改造型TILs新產品的研發平臺,通過基因編輯,對TILs的功能和性質進行優化,以進一步提高療效)、T-Programmer平臺(表觀遺傳重編程型TILs新產品的研發平臺,使用低劑量表觀遺傳調控化合物,對TILs進行重編程,以獲得更強更持久的抗腫瘤作用)。
未來,公司將繼續秉持“高效、協作、正直、包容”的核心價值觀,積極完成聯合管線、基因修飾TILs等在內的產品管線,并努力致力于實現:“成為國內領先的細胞治療新藥劑產業化研發平臺”這一目標而努力。




 17312606166
17312606166