盡管最近在理解皮膚瘢痕方面取得了進展,但引發增生性瘢痕形成的機制仍然知之甚少。在本研究中,作者以單細胞分辨率研究成熟的人類肥厚性疤痕和小鼠的發展疤痕。與正常皮膚相比,作者發現瘢痕組織中大多數細胞類型的基因表達存在顯著差異。
成纖維細胞表現出最顯著的基因表達改變,顯示出獨特的纖維化特征。通過比較在小鼠瘢痕形成過程中上調的基因和在成熟的人類增生性瘢痕中高表達的基因,作者確定了一組絲氨酸蛋白酶,初步參與瘢痕形成。其中二肽多肽酶4 (DPP4)和尿激酶(PLAU)在功能分析中進一步分析,揭示了tgf β1介導的肌成纖維細胞分化和體外細胞外基質成分過度生產的作用。局部應用DPP4和PLAU抑制劑在體內疤痕形成過程中顯示出抗纖維化活性和疤痕質量的改善,最顯著的是應用PLAU抑制劑BC-11后。

圖片來源:https://doi.org/10.1038/s41467-021-26495-2
增生性瘢痕是一個復雜的醫學問題,估計有1億人患有瘢痕造成的全球疾病負擔。在西方世界,每年大約有1100萬人有瘢痕疙瘩,400萬人有燒傷疤痕。據估計,美國每年用于皮膚瘢痕治療的費用達120億美元。對患者而言,病理性增生性疤痕可導致顯著的功能損害、疼痛、瘙癢和生活質量下降。
傷口愈合是一個緊密協調的三步過程,其特征是急性炎癥期、增殖期和重塑期。延長炎癥導致成纖維細胞(FB)活性增加,轉化生長因子β1 (TGFβ1)、TGFβ2、胰島素樣生長因子(IGF1)和其他細胞因子分泌增加。TGFβ1促使fb向肌成纖維細胞分化,肌成纖維細胞具有收縮表型,以ecm成分過度分泌為特征,是肥厚性瘢痕形成的主要貢獻者。成熟的增生性瘢痕顯示強烈的組織收縮,密集、平行或輪狀的ECM。
局部硅膠涂抹、壓迫或按摩治療、病灶內注射曲安奈德(TAC)、皮質類固醇或5-氟尿嘧啶(5-FU)、激光消融和手術是預防或治療肥厚性瘢痕最常用的選擇。然而,許多這些療法缺乏有效性和安全性的證據,顯示高復發率,作用機制仍不清楚。
最近,一些蛋白酶成為纖維化疾病藥物開發的重點,因為它們被證明參與ecm分解和組織重建中生長因子的激活。絲氨酸蛋白酶/肽酶組成了一個大的、多樣化的蛋白酶群,分為13個家族和40個家族。胰蛋白酶組包括參與凝血、纖溶、凋亡和免疫等重要過程的蛋白酶。這個家族的成員包括尿激酶、高溫需要A1/3肽酶、多種凝血因子和補體成分、類prss絲氨酸蛋白酶、顆粒酶和組織蛋白酶G。在人類體外研究和小鼠實驗中,PLAU的抑制劑已經被證明可以對抗心臟和肺纖維化的纖維化過程。
近年來,隨著DPP4抑制劑(gliptin)在臨床上用于治療糖尿病,絲氨酸蛋白酶DPP4成為關注的焦點。DPP4還與多種纖維化病理有關,包括心臟、肝臟、腎臟和皮膚纖維化,在動物模型中,抑制DPP4活性可減輕纖維化過程。然而,絲氨酸蛋白酶對人類瘢痕形成的貢獻和潛在的抗纖維化機制目前尚不清楚。盡管scRNAseq以前通過研究小鼠傷口愈合來確定胚胎和產后皮膚發育以及組織再生的重要因素,但單細胞水平的疤痕組織尚未被研究。
兩個時間點的小鼠瘢痕模型確定了瘢痕成熟過程中的調控基因。
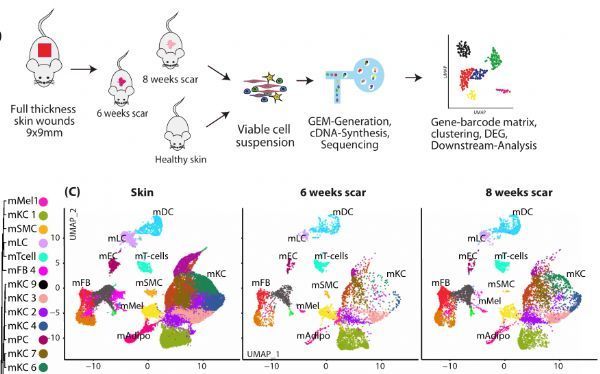
圖片來源:https://doi.org/10.1038/s41467-021-26495-2
在這里,作者使用scRNAseq深入研究了增生性瘢痕形成的基因表達和機制。作者的目的是識別在疤痕組織中調控的基因,并為無疤痕創面愈合或現有疤痕完全逆轉的藥物開發找到潛在的靶點。總之,該研究提供了增生性瘢痕的遺傳景觀,這是進一步研究基因和纖維化過程的基礎,迄今為止沒有在皮膚瘢痕的背景下研究。該體外和體內方法建議使用絲氨酸蛋白酶抑制劑作為預防或改善增生性疤痕發展的治療選擇。




 17312606166
17312606166