在一項(xiàng)新的研究中,來自美國(guó)范安德研究所、瑞典隆德大學(xué)和意大利佛羅倫薩大學(xué)的研究人員開發(fā)一種將使人們能夠更好地了解阿爾茨海默病如何在大腦中進(jìn)展的新模型。相關(guān)研究結(jié)果近期發(fā)表在Acta Neuropathologica Communications期刊上,論文標(biāo)題為“Proteomic analysis across patient iPSC-based models and human post-mortem hippocampal tissue reveals early cellular dysfunction and progression of Alzheimer’s disease pathogenesis”。

與其他神經(jīng)退行性疾病一樣,阿爾茨海默病的研究也極具挑戰(zhàn)性。它極其復(fù)雜,發(fā)病時(shí)間長(zhǎng),而且因人而異。至關(guān)重要的是,科學(xué)家們還缺乏監(jiān)測(cè)人類大腦中疾病進(jìn)展的非侵入性技術(shù)。相反,他們往往依賴于模擬這種疾病的模型來跟蹤阿爾茨海病的產(chǎn)生及其影響大腦的方式。
論文共同通訊作者、范安德研究所副教授Laurent Roybon 博士說,“模型要發(fā)揮作用,就必須密切反映阿爾茨海默病在現(xiàn)實(shí)生活中的進(jìn)展方式。我們的新模型再現(xiàn)了這一過程的許多關(guān)鍵方面。這項(xiàng)新研究的優(yōu)勢(shì)之一是我們使用了源自阿爾茨海默病患者的細(xì)胞系,這有助于我們?cè)谶@種模型中更好地反映實(shí)際的疾病過程。”
這種新模型利用了誘導(dǎo)性多能干細(xì)胞(induced pluripotent stem cell, iPSC)。在此基礎(chǔ)上,人們可以誘導(dǎo)iPSC細(xì)胞變成神經(jīng)元等其他類型的細(xì)胞。這種強(qiáng)大的技術(shù)讓科學(xué)家們可以研究與患者具有相同遺傳背景的人類腦細(xì)胞。
然而,在大腦微環(huán)境之外研究這些細(xì)胞又是一個(gè)挑戰(zhàn)。腦細(xì)胞得益于一個(gè)受到嚴(yán)格調(diào)節(jié)的能促進(jìn)細(xì)胞健康和功能的生態(tài)系統(tǒng)。為了解決這個(gè)問題,這些作者使用源自阿爾茨海默病患者的 iPSC來產(chǎn)生腦細(xì)胞。他們?nèi)缓髮⑦@些腦細(xì)胞移植到免疫缺陷的野生型小鼠的大腦中,并監(jiān)測(cè)阿爾茨海默病特征性病變---蛋白斑塊和纏結(jié)物、炎癥、線粒體功能障礙以及病變?cè)谡麄€(gè)大腦中移動(dòng)的能力---的發(fā)展情況。
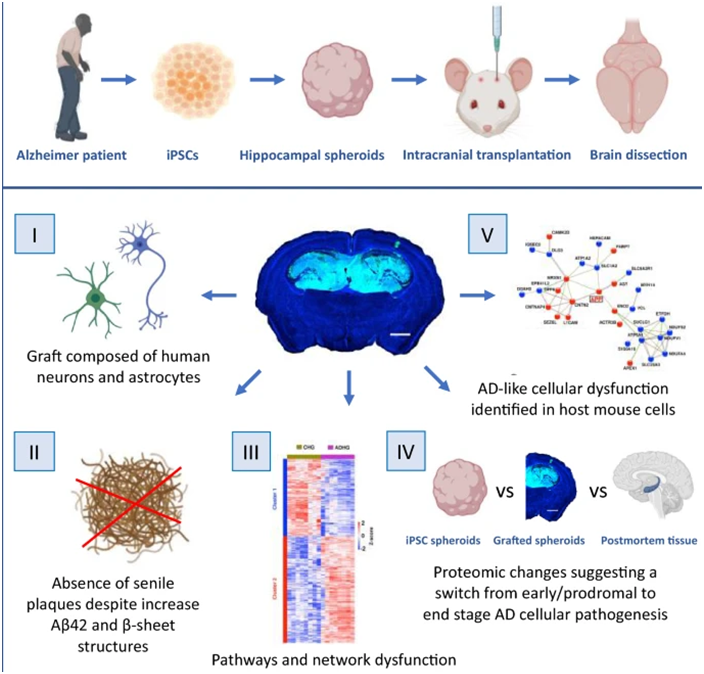
圖片來自Acta Neuropathologica Communications, 2023, doi:10.1186/s40478-023-01649-z。
這些作者發(fā)現(xiàn),該模型成功再現(xiàn)了大腦通路中可能會(huì)導(dǎo)致淀粉樣蛋白斑塊形成的關(guān)鍵變化,還再現(xiàn)了鄰近腦細(xì)胞中與疾病相關(guān)的變化,這是疾病病理可能在細(xì)胞間擴(kuò)散的跡象。蛋白質(zhì)組分析還揭示了從疾病早期到晚期的變化。
這種新模型解決了阿爾茨海默病研究中的一個(gè)核心問題:盡管體外細(xì)胞模型和小鼠模型長(zhǎng)期以來一直在幫助研究這種疾病,但將兩者結(jié)合起來能更準(zhǔn)確地反映這種疾病在人類身上的產(chǎn)生和進(jìn)程。這類模型被稱為嵌合模型,結(jié)合了體外細(xì)胞模型和小鼠模型的優(yōu)勢(shì)。
Roybon說,下一步將監(jiān)測(cè)細(xì)胞病理學(xué)如何在更長(zhǎng)的時(shí)間范圍內(nèi)發(fā)展,并研究病理學(xué)如何根據(jù)導(dǎo)致阿爾茨海默病的多種基因突變而有所不同。此外,這些作者還計(jì)劃解決他們的新模型的局限性,比如產(chǎn)生更能反映大腦特定區(qū)域細(xì)胞群體的 iPSC細(xì)胞。




 17312606166
17312606166