長期和短期接觸碳納米顆粒 (CNP) 會影響胎兒發育和隨后的不良后果,包括早產、宮內生長受限、低出生體重、與成年期心血管、呼吸和神經系統相關的健康風險增加。CNPs 的不良發育結果是眾所周知的,但其潛在機制仍未知。 本研究用50、100、200μg/mL的CNPs處理斑馬魚胚胎,觀察其毒性作用。使用 RNA-seq 分析方法,我們研究了 CNP(200 μg/mL)對受精后 4 到 96 小時(hpf)暴露的斑馬魚胚胎基因表達的影響。我們觀察到CNPs處理的胚胎畸形增加,孵化減少。轉錄組分析共檢測到236個差異表達基因,這些基因與光轉導、氨基酸代謝、類固醇和類固醇激素生物合成有關。通過實時熒光定量 PCR (RT-qPCR) 驗證轉錄組結果。 我們的研究結果表明,CNPs 暴露最有可能導致類固醇和激素生物合成途徑中的差異基因變化,從而誘導發育毒性,例如斑馬魚胚胎的延遲孵化、畸形率增加和多種畸形表型。
關鍵詞:碳納米顆粒 斑馬魚胚胎 轉錄組分析 發育毒性 畸形表型
簡介:黑碳(BC)存在于細顆粒和超細顆粒的大氣顆粒中,主要粒徑小于1μm,主要粒徑小于0.18μm。一些研究發現,環境空氣中的納米BC顆粒很容易進入人體,并遷移到更深的循環系統中。例如,Maher等人在尸檢大腦樣本的額葉皮質中檢測到了來自空氣污染的燃燒衍生納米顆粒。此外,在所有受試兒童的尿液中檢測到BC,總平均值(SD)為98.2×105(29.8×105)粒/毫升。在所有篩查的胎盤中都發現了 BC,低暴露和高暴露女性的平均 (SD) 粒子計數分別為 0.95 × 104 (0.66 × 104) 和 2.09 × 104 (0.9 × 104) /mm3 粒子。胎盤BC負荷與孕婦在妊娠期間的家庭BC暴露呈正相關。為了研究長期暴露于碳納米顆粒 (CNP) 對生物體的影響,Wistar 大鼠被重復腹膜內注射 給藥4 周。注射前,將純粉末納米粒子以 500 mg/L 的濃度懸浮在無菌鹽水溶液中。 結果表明,納米粒子在注射部位附近的腹腔內主要以聚集體形式存在,肝臟的腸系膜和漿膜也觀察到了小的聚集體,表明納米粒子可能已經轉移到肝臟。另一項研究使用雞胚模型,通過將濃度為 500 μg/mL 的實驗溶液注射到卵白蛋白中來研究六種不同類型 CNP 的毒性。孵育5、10、15和20天后觀察大體病理學和存活率。 培養 20 天后,采集血樣并測量器官重量。結果表明,CNPs能降低胚胎的相對存活率,并在循環中存活,無明顯副作用,值得進一步研究。因此,公眾越來越關注含BC的CNP的安全性,需要對這些納米大氣顆粒物進行全面的毒性評估。
胎兒發育是暴露相關易感性的一個關鍵窗口。 成年期疾病的病因可能源于胎兒,并可能歸因于宮內環境暴露的不利影響。例如,暴露于燃燒相關的大氣顆粒物污染(包括BC)與早產和宮內生長受限有關。此外,圍產期接觸 BC 也會在成年后誘發一系列疾病。 斑馬魚胚胎是探索發育毒理學機制的最有希望的模型之一。為了研究氧化鋯納米顆粒(ZrO2 NPs)對胚胎發育的影響,斑馬魚胚胎在受精后24–96 hpf內注射0.5、1、2、3、4或5μg/mL的ZrO2 NPs。結果表明,0.5~1 μg/mL的濃度可引起胚胎急性發育毒性,并觀察到胚胎死亡、孵化延遲和畸形。暴露于ZrO2NPs會導致軸向彎曲、尾部彎曲、脊髓彎曲、卵黃囊和心包水腫。另一項研究調查了 CuO NPs 對斑馬魚胚胎的發育毒性。 受精后 4 小時至 96 hpf的斑馬魚胚胎暴露于不同濃度的 CuO NPs (0.5, 1,1.5 mg/L)。結果表明,CuO NPs 不能進入斑馬魚胚胎組織,但可能導致死亡率增加、孵化延遲和心率下降。此外,CuO NP可導致頭尾畸形、脊椎畸形、卵黃囊水腫、心包水腫和其他類型的異常。暴露于 30 μg/mL CNPs 60 天,已觀察到成年斑馬魚心臟組織中吸收的碳顆粒的位置,并證明了含有 BC 的 CNPs 對斑馬魚心臟的潛在慢性影響。然而,BC 和含 BC 的 CNP 暴露影響胚胎發育的機制仍不清楚。因此,該研究選擇斑馬魚胚胎作為實驗對象,購買CNPs作為實驗室替代品,以替代真實世界中含有BC的CNPs。斑馬魚胚胎在24、48、72和96hpf的孵化率和畸形指數被認為是在暴露于CNPs后檢測到的。 此外,對對照組和暴露于 200 μg/mL CNPs 的斑馬魚進行了轉錄組比較,以更好地了解差異表達基因 (DEGs) 和 CNPs 誘導胚胎發育毒性的潛在機制路徑。
CNPs對斑馬魚胚胎的毒性作用:48hpf對照組的孵化率為19.17%,而50、100和200 μg/mL濃度組的孵化率分別為5.83%、5.00%和2.50%,顯著低于對照組。72hpf對照組的孵化率為89.17%,而50、100和200μg/mL濃度組的孵化率分別為52.50%、48.33%和48.33%,也顯著低于對照組。此外,50、100和200μg/mL(96hpf)的畸形率分別為39.02%、50.68%和77.14%。已發現畸形胚胎,包括眼發育不全、心包水腫、血液循環障礙、卵黃囊畸形、脊索彎曲、尾巴彎曲、黑素細胞減少、心跳減慢,畸形數量隨著劑量和時間的增加而增加。在200μg/mL濃度組中,眼部發育不良、卵黃囊畸形和血液循環障礙等畸形的數量顯著高于其他組。僅在最高濃度組觀察到對觸摸無反應的異常現象。
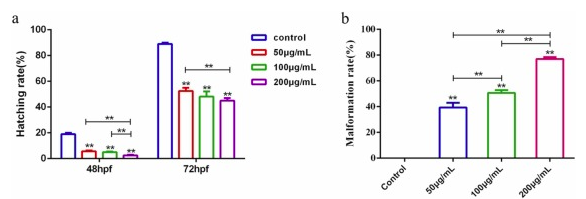
圖1、不同濃度組斑馬魚的孵化率和畸形率。(a)不同濃度組的48hpf和72hpf孵化率。(b) 不同濃度組的96hpf畸形率。

圖 2、 96 hpf 時暴露于 50,100,200?μg/mL CNPs 引起的表型變化。
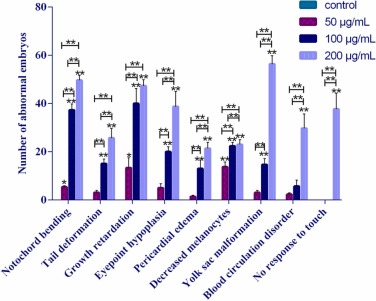
圖 3、96 hpf 暴露于 CNP 的斑馬魚胚胎不同類型畸形的數量。
CNPs對基因表達的影響:RNA-seq 數據顯示,在 200?μg/mL CNP 和對照組中,從胚胎樣本中獲得的平均無污染讀數分別為 21876005 和 22549680。兩個樣本的平均基數比 6?G 更顯著。總的來說,這些結果表明數據質量可以滿足進一步的分析。對暴露于CNPs的正常斑馬魚胚胎進行RNA-seq和基因表達譜分析表明,共有236個基因差異表達,其中102個基因顯著減少,134個基因顯著增加。然后,對所有發生顯著變化的DEG進行GO富集分析和進一步的KEGG富集分析。DEGs的顯著富集有幾個GO術語,包括“生長”、“節律過程”、“細胞外區域”、“抗氧化活性”和“解毒”。為了更好地研究 CNPs 對斑馬魚差異基因表達的調控,基于 KEGG 通路數據庫,DEGs 在功能上被歸類為典型的信號通路。根據top值,“光轉導”、“甘氨酸、絲氨酸和蘇氨酸代謝”、“丙氨酸、天冬氨酸和谷氨酸代謝”、“類固醇生物合成”、“類固醇激素生物合成”是主要的顯著調節途徑。KEGG富集網絡圖顯示,CNPs破壞了斑馬魚胚胎光轉導途徑中的基因表達,包括兩個上調基因(enam、guca1e)和四個下調基因(guca1c、loc110437775、opn1mw2),以及7個氨基酸代謝途徑中的差異表達基因,包括5個下調基因(ASN、abat、psat1、gcshb、pipox)和2個上調基因(gls2b、agxtb)。此外,類固醇生物合成和類固醇激素生物合成途徑中有7個差異表達基因。 其中,上調基因為hsd17b7、cyp3a65、cyp51和sqlea,下調基因為cyp1a、sult5a1、ugt2b3。
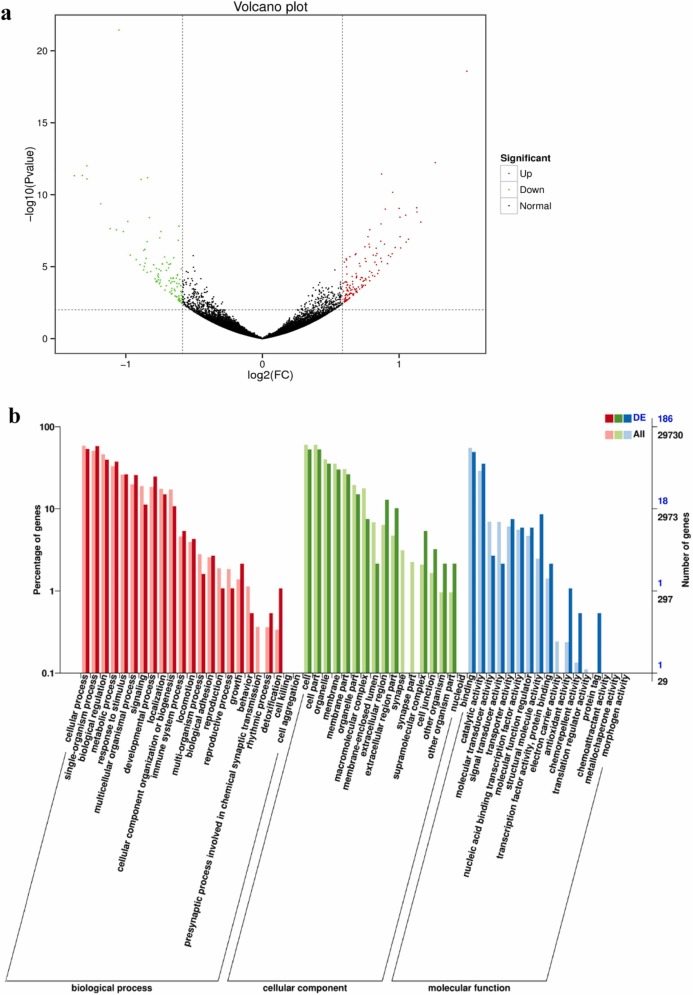
圖 4. 96hpf 暴露于 200?μg/mL 的 CNP 的轉錄組分析。
通過 RT-qPCR 驗證 DEG:選擇富含類固醇生物合成和類固醇激素生物合成途徑的DEGs,從RNA-Seq結果中選擇7個基因(sult5a1、sqla、ugt2b3、hsd17b7、cyp1a、cyp3a65和cyp51)的表達,通過qRT-PCR檢測驗證 RNA-Seq 數據。如圖 5 所示,對于上調和下調基因,qPCR 的結果與 RNA-seq 的結果非常吻合。
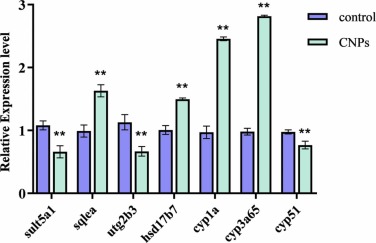
圖5、類固醇生物合成和類固醇激素生物合成信號通路中關鍵基因的表達和驗證。
討論:不同濃度的 CNPs 可誘導顯著的發育毒性。 與對照組相比,CNPs顯著干擾斑馬魚胚胎的正常發育,且孵化延遲和致畸作用呈時間和劑量依賴性。類似的研究表明,丁二烯煙灰 (BDS) 納米顆粒可能導致斑馬魚發育毒性,包括心包水腫、卵黃囊腫脹、軸向畸形。在這項研究中,觀察到卵黃囊畸形,這可能會影響營養代謝,從而影響胚胎發育。 在蛋黃發育過程中,胚胎可以利用蛋黃中積累的內源性營養物質。在魚卵中,內源性脂質儲備,主要是磷脂和三甘油,以卵黃球的形式存在。對卵黃囊的影響也可能是由于脂質合成和代謝的改變。卵黃囊的任何損傷都可能阻礙胚胎發育期間的營養供應,這可能是異常發育的原因。結果表明,在CNPs誘導的斑馬魚胚胎發育毒性的許多異常表型中,48/72/96 hpf發現脊索彎曲呈劑量依賴性。脊索彎曲是本研究中觀察到的最重要的表型變化之一,可能導致胚胎骨骼畸形。心臟發育是胚胎發生的重要終點。 在我們的研究中,我們發現斑馬魚胚胎有心包水腫和心臟血液循環障礙。2019年的一項研究表明,CNPs可以引起心肌組織顯著的超微結構變化,并以劑量依賴性方式誘導炎癥因子的表達,導致心內膜下炎癥和細胞凋亡。此外,本研究觀察到斑馬魚眼發育不全,可能影響斑馬魚的視覺發育。RNA-Seq 分析表明,光轉導、氨基酸代謝、類固醇和類固醇激素生物合成途徑比其他途徑顯著富集了更多的 DEG。在實驗中,CNPs溶液呈黑色,尤其是濃度越高,CNPs溶液的顏色越深,這表明暴露組和對照組的光線不同。光在斑馬魚的發育中起著重要作用,影響視網膜的總厚度和感光細胞層的厚度,從而影響視覺的發展。色素減退是斑馬魚在沒有光照條件下發育時通常發生的一種變化。其他研究強調,暴露于斑馬魚胚胎/幼蟲中的污染物可能會改變與發育性眼病相關的晶體蛋白基因的基因表達水平。此外,暴露于氯氰菊酯48小時后,斑馬魚幼蟲的眼睛發育毒性可能會改變與視覺相關的基因,擾亂斑馬魚胚胎的光誘導途徑。在本研究中,我們觀察到斑馬魚的眼部發育不良和黑素細胞減少,以及光轉導途徑的異常表達,這表明應使用敲除模型動物來探索毒性效應與機制途徑之間的關系。
類固醇和激素生物合成途徑是斑馬魚胚胎發育、代謝和內分泌的重要途徑。RNA-seq分析和RT-qPCR數據強調,CNPs暴露誘導的斑馬魚胚胎毒性可能與甾體生成途徑中關鍵酶的基因突變有關。膽固醇作為類固醇激素的前體分子。 激素產生的限速步驟是將膽固醇轉運到線粒體內基質,在那里它轉化為孕烯醇酮。轉錄組測序結果表明,sqlea是膽固醇代謝的關鍵基因之一。孕烯醇酮進入內質網進行進一步的酶促反應,產生各種類固醇激素。類固醇激素對性器官和行為的組織和發育、免疫功能、生長和應激反應都很重要。細胞色素P450酶具有區域特異性,對于催化甾體生成途徑中的甾體原特異性反應至關重要,我們的研究還發現了細胞色素P450酶基因的關鍵差異,包括cyp1a、cyp51、cyp3a65和ugt2b3。研究表明,cyp11a1在具有卵黃合胞層、染色體間原基、染色體間腺的斑馬魚胚胎中表達。胚胎斑馬魚的芯片分析和原位雜交顯示,cyp51在眼腦和尾鰭的額葉表皮細胞中強烈表達,表明cyp51和其他異戊二烯合成酶可能在造血和血管發育中發揮作用。大多數CYP在發育過程中的作用和調節是未知的,阻礙了對發育毒性機制的理解。此外,催乳素受體相關蛋白/17β-羥基類固醇脫氫酶7型基因(hsd17b7)在胚胎發育和胎兒存活中起著關鍵作用。研究表明,敲除hsd17b7功能可能導致小鼠胚胎死亡、腦畸形和心臟缺陷。此外,胚胎發育中類固醇生物合成的途徑尚未闡明。雖然類固醇激素在成年斑馬魚中的作用已經得到了很好的研究,但它們對早期胚胎發育的影響還遠未清楚。進一步闡明類固醇和激素生物合成途徑在斑馬魚胚胎發育中的毒性機制可能很重要。
總之,我們首次證明了斑馬魚胚胎暴露于CNPs的發育毒性。RNA-Seq分析和RT-qPCR數據表明,CNPs暴露主要影響光轉導、氨基酸代謝、類固醇和類固醇激素生物合成途徑的DEGs。這些數據可以提供進一步可能的研究方法,以更好地了解 CNP 在胚胎發育中的毒理學機制。
原文出自:The developmental toxicity and transcriptome analyses of zebrafish (Danio rerio) embryos exposed to carbon nanoparticles - ScienceDirect




 17312606166
17312606166