腎臟,俗稱“腰子”,是人體泌尿系統中最重要的器官,對人類健康具有至關重要的作用。它的基本功能是生成尿液,清除體內代謝廢物,重吸收葡萄糖、氨基酸、鈉離子、水等各類有用物質,此外腎還具有調節血液電解質和酸堿平衡,分泌激素等重要功能。
腎臟位于脊柱兩側,左右各一,紅褐色,形似蠶豆,表面光滑,每個腎的重量大概在100—200克,受肝臟影響,右腎一般比左腎略低1-2厘米。腎臟皮質呈紅褐色,分為外緣和內緣兩部分,腎外緣為凸面,內緣為凹面,凹面中部為腎門,所有血管、神經及淋巴管均由此進入腎臟,腎盂則由此走出腎外[1]。
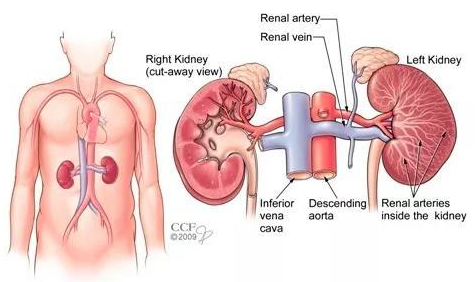
圖1.腎臟的位置和結構
腎單位是腎臟結構和功能的基本單位,由腎小體和腎小管組成,腎小體又由腎小球和腎小囊組成。每個腎臟約有一百多萬個腎單位,腎不能再生新的腎單位。腎單位是腎臟部位物質交換和能量傳輸的重要系統,包括腎小球濾過血液形成原尿,腎小管、集合管重吸收營養物質和毛細血管物質交換過程。因此,腎單位是腎臟微循環系統發揮作用的基本單位,對腎臟各功能的的正常運轉起著決定性作用。
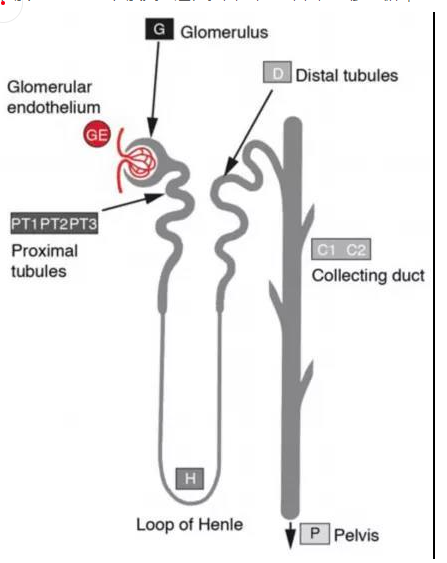
圖2.腎單位示意圖[2]
按照細胞類型,腎臟可以劃分出5類固有細胞,分別是系膜細胞(mesangium)、內皮細胞(endothelium)、足細胞(podocyte)、腎小管上皮細胞和腎間質成纖維細胞。
系膜細胞對腎小球毛細血管具有支持和保護作用,它能調節毛細血管的收縮和舒張,通過平衡毛細血管的血流量,控制濾過膜的濾過功能。系膜細胞還具有吞食功能,可吞噬一些大分子物質,包括殘留在基底膜上的沉積物。此外,系膜細胞還能合成分泌多種酶和生物活性物質,參與基底膜的修復、免疫反應、腎小球炎癥反應等多種生理過程。
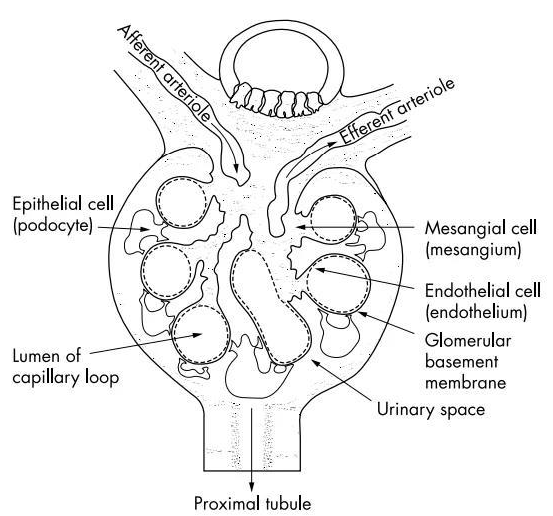
圖3. 腎小球切面上不同細胞的位置
系膜細胞受損會影響腎小球的有效濾過面積,影響腎臟的血液過濾功能;系膜細胞異常增生往往是腎小球硬化的前奏;此外系膜細胞上表達有多種免疫受體,其異常還會導致腎臟容易患上各類感染性疾病。
內皮細胞具有維持腎小球毛細血管結構完整的屏障功能,它是選擇性濾過屏障功能的第一道防線(70~100nm),具有抗凝、抗血栓形成和調節腎小球血流動力學的作用,此外內皮細胞與系膜細胞一起參與基底膜的合成和修復。內皮細胞受損后,其抗凝活性下降,導致外凝血微血栓的形成;它的細胞表型也會發生改變,會釋放一系列導致腎臟纖維化的細胞因子。
足細胞是腎小球濾過屏障的一部分,相鄰足細胞突起之間形成柵欄狀的交叉,交叉之間的空隙稱為裂孔,裂孔直徑較小(40nm),能阻隔大分子通過,起到機械屏障的作用;此外足細胞還能分泌帶負電荷的唾液酸糖蛋酶等物質,起到電荷屏障的作用。足細胞是腎臟最容易出現病變的細胞,足細胞受損會導致裂孔閉塞,電荷屏障功能障礙,導致膜性腎病;嚴重的還會出現足細胞纖維化,進而導致腎小球硬化。
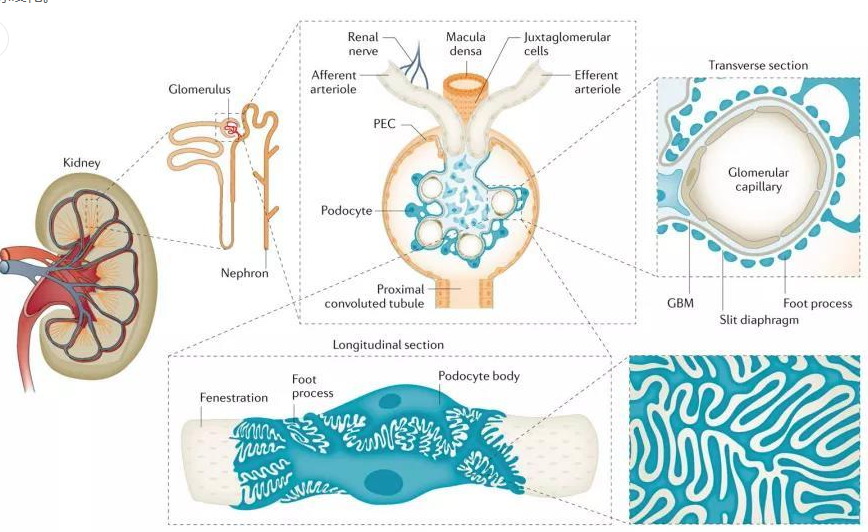
圖4.足細胞位置及形態[3]
腎小管上皮細胞的主要生理功能有對原尿進行重吸收和稀釋,保持血液的電解質平衡和酸堿平衡等。腎小管上皮細胞受損后會導致夜尿增多,電解質紊亂,酸中毒等癥狀。
間質成纖維細胞具有維持腎臟正常結構的功能,它參與構成濾過屏障、同時還具有修復功能。間質成纖維細胞是促使腎臟發生纖維化的關鍵細胞,病理情況下間質成纖維細胞的異常增殖會產生大量細胞外基質,進而導致整個腎臟的纖維化。
過去對腎細胞的分類主要是根據其功能、解剖位置或少量標記基因,現在隨著單細胞測序技術的成熟和廣泛應用,腎臟單細胞測序的文章越來越多,鑒定出的細胞類型也越來越多。目前發現除了5類固有細胞外,腎臟中還有間充質細胞、單核細胞、肥大細胞等多種不同細胞。
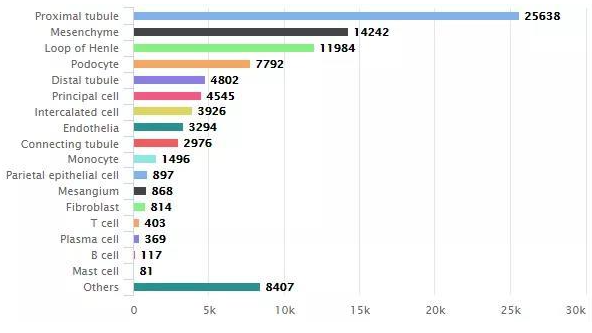
圖5.腎臟細胞分型[4]
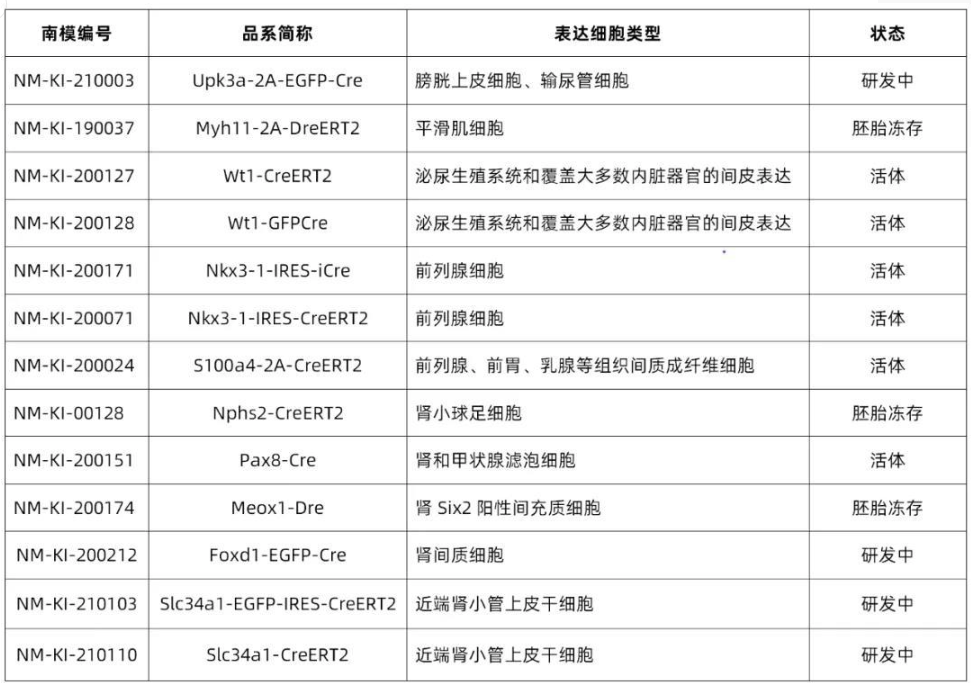
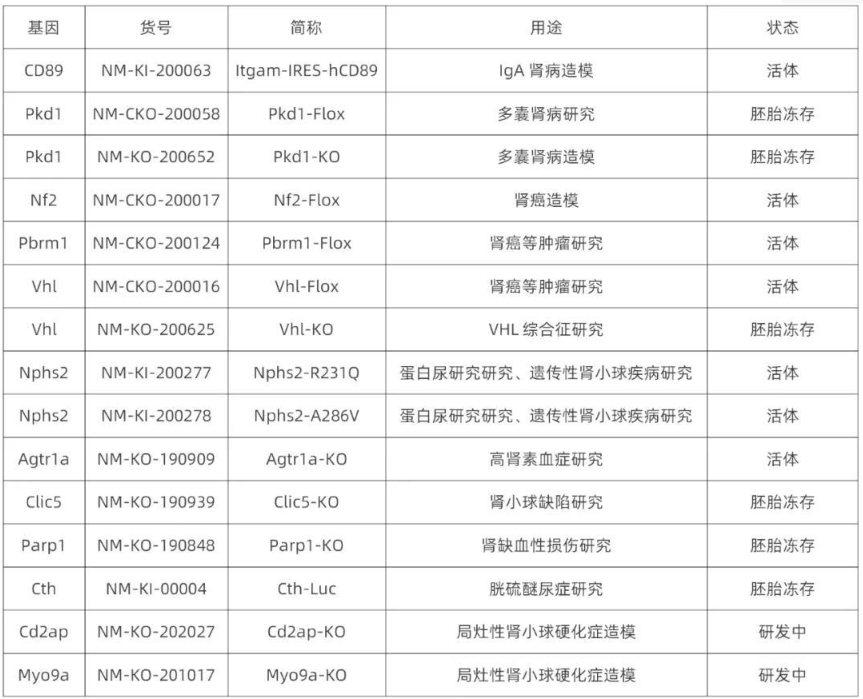
南模生物在小鼠泌尿系統(包含腎臟)特定細胞類群marker基因中敲入Cre重組酶元件或報告基因,研究者可以對每類細胞進行標記,還可以在特定細胞群里進行基因及細胞功能的研究。具體模型信息見下表:
對于腎臟疾病,我們往往有2個認識上的誤區。第一,雖然保健品廠家鋪天蓋地的宣傳腎好性功能好,但實際上兩者并無關聯;第二,腎臟疾病的發病率其實很高,全球平均每十個人中就有一個慢性腎病患者,僅我國就有1億多人。腎病已成為繼心腦血管疾病、腫瘤、糖尿病之后,人類生命健康面臨的主要威脅之一。下面小編為大家介紹幾種常見的腎臟疾病和相應的研究模型。
免疫球蛋白A(IgA)腎病是世界范圍內最常見的原發性腎小球疾病,也是我國最常見的腎小球疾病,占原發性腎小球腎炎的30%-40%。IgA腎病可表現為各種臨床綜合征,包括無癥狀性血尿或蛋白尿、慢性腎小球腎炎、急進性腎炎或腎病綜合征。IgA腎病的病理機制還未完全明確,目前被廣泛接受的理論認為,IgA腎病是多種機制共同導致的,而非單一機制,被稱為“多重打擊假說”,此假說有4個環節:①異常糖基化IgA1,進而生成Gd-IgA1;②被循環系統中抗聚糖的自身抗體識別;③導致腎炎的免疫復合物沉積在系膜區;④激活系膜細胞。
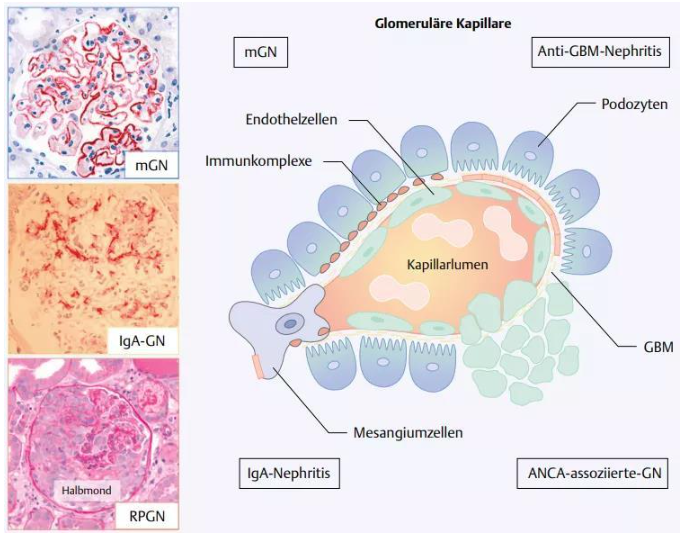
圖6.腎小球腎炎發生示意圖[5]
最近的研究表明,粘膜和補體免疫系統在IgA腎病中也發揮重要作用。例如,血尿的出現和粘膜免疫相關,而循環免疫復合物中常常可以發現補體,例如C3補體和補體因子H。
在人類中,IgA的主要受體為CD89,而小鼠不表達CD89,因此為了構建類人表型的IgA腎病模型,上世紀九十年代末,Launay開發了由CD11b啟動子控制的、表達人CD89的轉基因小鼠[9]。該小鼠在單核細胞/巨噬細胞上表達人的CD89,在生長晚期,出現IgA的腎小球內沉積、系膜擴張和巨噬細胞浸潤。
受到該研究啟示,南模生物構建了Itgam-IRES-hCD89小鼠模型,可方便全球科學家進行IgA腎病研究及新藥研發。
腎癌,又稱腎細胞癌(RCC),是泌尿系統最常見的腫瘤之一,在我國腎癌發病率僅次于膀胱癌,位居泌尿系統腫瘤第2位。腎癌有多種不同的類型,如腎透明細胞癌、乳頭狀腎細胞癌、腎嫌色細胞癌、多房囊性腎細胞癌等,其中腎透明細胞癌最常見,約占所有腎癌的90%。腎癌可分為四期,發現的越早預后越好,I期、II期腎癌的5年生存率分別可達95%和88%,而IV期腎癌的5年生存率僅有20%。
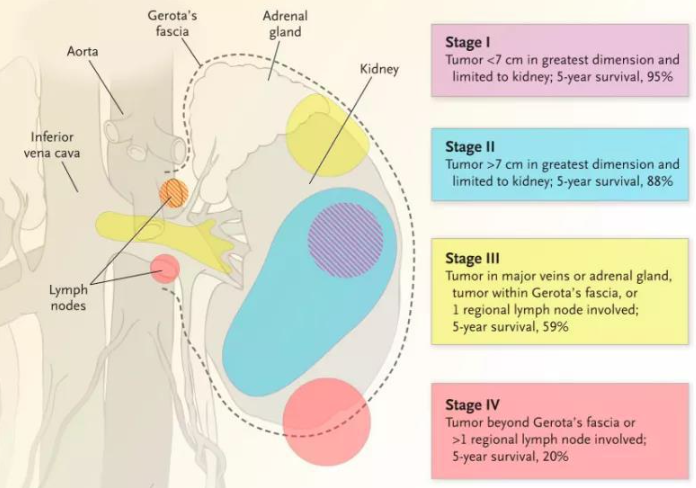
圖7.腎腫瘤大小與生存率[6]
腎癌的發病與多個基因密切相關,如:
- VHL基因:其突變不僅與家族性的透明腎細胞癌(CCRCC)有關,而且70%以上的散發性CCRCC也帶有VHL突變,是目前腎癌中突變率最高的腎腫瘤抑制基因。
- PBRM1基因:主要與CCRCC有關,在CCRCC中的突變率達40%,僅次于VHL基因。
- FLCN基因:該基因突變可引起Birt Hogg Dube綜合征,該病患者全身多處會出現纖維毛囊瘤,約有34%的BHD病人會發展成腎癌。
除上述主要突變基因外,還有FH、TSC1/TSC2、MET、SETD2、BAP1、JARID1c/KDM5C、UTX/KDM6A、NF2、MLL2、CUL7和BRTC等基因與腎癌發病存在一定的關聯。
Zachary利用NF2-flox小鼠與Villin-Cre交配,獲得了可以自發腎癌的小鼠模型[10],其在 15 日齡時就可以觀察到腎小管上皮的損傷,到 3 個月大時,會出現腎小管管內瘤變,到 6 個月時,腫瘤的大小和數量增加,可以穿透小管基底膜,進展為浸潤性癌。
受到該研究啟示,南模生物構建了NF2-flox小鼠,方便全球科學家進行自發腎癌模型構建,除此之外,還構建了腎癌發生相關基因VHL、PBRM1的敲除和條件性敲除小鼠模型,方便腎癌發生機理研究。詳細的模型信息見文末表格表格。
囊性腎病是指在腎臟出現單個或多個內含液體的良性囊腫性腎臟疾病,以單純性腎囊腫最常見,其次為多囊腎。腎臟超聲檢查已成為基礎的體檢項目,而越來越多的人也被超聲報告單上的左腎囊腫或右腎囊腫、甚至雙腎囊腫這樣的報告所困擾。實際上,單純性腎囊腫是成年人腎臟最常見的一種結構異常,占所有囊腫性腎臟疾病的70%左右,發病率隨年齡增長而增多。如果沒有癥狀,對腎臟功能和周圍組織影響不大,單純性腎囊腫一般是不需要治療的,只要每半年到一年隨診就可以。

圖8.PKD1突變與多囊腎的相關性[7]
多囊腎病(PKD)的危害則大得多,PKD是最常見的遺傳性腎臟疾病,包括常染色體顯性遺傳性腎病(ADPKD)和常染色體隱性遺傳性腎病(ARPKD)。ADPKD具有遺傳異質性,位于16號染色體上的PKD1基因(見于85%的病例)或位于4號染色體上的PKD2基因(見于15%的病例)突變與發病密切相關。PKD1和PKD2基因分別編碼完整的膜蛋白多囊蛋白-1和多囊蛋白-2,兩者結構相似,可發生相互作用。PKD1或PKD2的突變可導致信號失調,環磷酸腺苷水平升高,最終導致囊腫生成。
上世紀90年代末,Zhou J等通過同源重組將 Pkd1 截斷突變引入小鼠,模擬 ADPKD 中發現的突變。Pkd1敲除雜合子小鼠沒有明顯的表型,而純合子在圍產期死亡,伴有大量增大的腎囊腫、胰管囊腫和肺發育不良。腎囊腫的形成始于胚胎第 15.5 天 (E15.5) 在近端小管中,并迅速進展以取代整個腎實質。到出生后第8天,存活的純合子小鼠腎實質幾乎完全被囊腫取代[11]。受該研究啟示,南模生物自主構建了PKD1敲除和條件性敲除的小鼠,可用于多囊腎病的研究,詳細模型信息見文末表格。
局灶節段性腎小球硬化(FSGS)并不是特定的疾病,而是一種病理改變。它既可以描述以原發性足細胞損傷為特征的疾病,也可以描述其它類型慢性腎臟疾病(CKD)中的繼發病變。FSGS 主要分為原發性、繼發性和遺傳性三類。其中原發性是由腎臟本身的病變導致;繼發性則是指有明確的病因,包括病毒(HIV)、藥物和毒素(鋰中毒)、腎組織減少(孤立腎)、腎缺血缺氧(高血壓腎損害、腎動脈狹窄)、重度肥胖等。
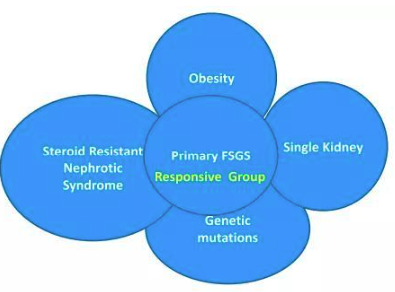
圖9.FSGS的常見誘因[8]
引起FSGS的致病基因包括 NPHS1/2、CD2AP、MYO1E、MYO9A等,這些基因突變引起的 FSGS 具有常染色體隱性遺傳的特點,患者常于兒童時期發病。a-actinin-4、TRPC6 和 INF2 的突變則表現為常染色體顯性遺傳,患者多于成人期發病,一般無明顯的腎病綜合征表現。
Indra R Gupta 和Alda Tufro分別構建了Cd2ap和Myo9a敲除的小鼠,發現這些小鼠會出現腎臟發育異常、蛋白尿、腎小管萎縮等FSGS疾病的癥狀[12,13]。受此啟發,南模生物自主構建了Cd2ap和Myo9a的敲除小鼠模型,可用于FSGS的研究,詳細模型信息見文末表格。
南模生物自主構建了多種基因修飾小鼠,可用于IgA腎小球腎炎、腎癌、囊性腎等多種腎臟疾病的研究和藥物篩選。詳細模型信息見下表:
南模生物深耕基因編輯領域,提供全方位模式生物服務,包括基因修飾成品模型供應、個性化模型定制、飼養繁育、表型分析、藥效評價等,滿足不同實驗室需求。
[1]系統解剖學第八版. 柏樹令 應大君
[2]Science. 2018 August 10; 361(6402): 594–599.
[3]Nat Rev Dis Primers. ; 6(1): 68. doi:10.1038/s41572-020-0196-7.
[4]http://humphreyslab.com/SingleCell/
[5]Stahl, Rolf; Hoxha, Elion (2016). Glomerulonephritis. DMW - Deutsche Medizinische Wochenschrift, 141(13), 960–968. doi:10.1055/s-0042-107410
[6]Cohen, Herbert T.; McGovern, Francis J. (2005). Renal-Cell Carcinoma. New England Journal of Medicine, 353(23), 2477–2490. doi:10.1056/NEJMra043172
[7]Nat Rev Dis Primers . 2018 Dec 6;4(1):50. doi: 10.1038/s41572-018-0047-y. Polycystic kidney disease
[8]Bose, B.; Cattran, D. (2014). Glomerular Diseases: FSGS. Clinical Journal of the American Society of Nephrology, 9(3), 626–632. doi:10.2215/CJN.05810513
[9]Launay P , Grossetete B , Arcos-Fajardo M , et al. Fcα Receptor (Cd89) Mediates the Development of Immunoglobulin a (Iga) Nephropathy (Berger's Disease)[J]. Journal of Experimental Medicine, 2000, 191(11):1999-2010.
[10]Morris Z S , Mcclatchey A I . Aberrant epithelial morphology and persistent epidermal growth factor receptor signaling in a mouse model of renal carcinoma[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(24):9767-9772.
[11]Nat Genet. 1997 Oct;17(2):179-81.doi: 10.1038/ng1097-179.Perinatal lethality with kidney and pancreas defects in mice with a targetted Pkd1 mutation
[12] Case Reports Kidney Int . 2019 Jan;95(1):57-61. doi: 10.1016/j.kint.2018.08.014. Epub 2018 Oct 26. Recessive mutation in CD2AP causes focal segmental glomerulosclerosis in humans and mice
[13] Kidney Int . 2021 May;99(5):1102-1117. doi: 10.1016/j.kint.2020.12.022. Epub 2021 Jan 4. Rho-GTPase Activating Protein myosin MYO9A identified as a novel candidate gene for monogenic focal segmental glomerulosclerosis




 17312606166
17312606166